Роксолана Коновалова
практикующий провизор, фармацевт высшей категории, специальность - фармация, консультант ZDOROVI.UA

не найдено в г. Киев
не найдено в г. Киев
Описание препарата Теваграстим раствор для ин. и инф. 48 млн МЕ шприц 0,8 мл №1 создано на основе официальной инструкции к Теваграстим раствор для ин. и инф. 48 млн МЕ шприц 0,8 мл №1 и представлено на сайте ZDOROVI.UA только для ознакомительных целей. Не следует использовать описание как инструкцию к самолечению. Проконсультируйтесь с врачом перед покупкой Теваграстим раствор для ин. и инф. 48 млн МЕ шприц 0,8 мл №1 и помните, что самолечение может быть опасно для Вашего здоровья!

Роксолана Коновалова
практикующий провизор, фармацевт высшей категории, специальность - фармация, консультант ZDOROVI.UA
діюча речовина: філграстим;
1 попередньо наповнений шприц (0,5 мл розчину) містить філграстиму 30 млн МО (300 мкг);
1 попередньо наповнений шприц (0,8 мл розчину) містить філграстиму 48 млн МО (480 мкг);
допоміжні речовини: кислота оцтова льодяна, полісорбат 80, натрію гідроксид, сорбіт (Е 420), вода для ін'єкцій.
· Скорочення тривалості нейтропенії і зменшення частоти фебрильної нейтропенії у хворих, які отримують цитотоксичну хіміотерапію з приводу злоякісних захворювань (за винятком хронічного мієлолейкозу і мієлодиспластичного синдрому).
· Скорочення тривалості нейтропенії у хворих, які отримують мієлоаблативну терапію з подальшою трансплантацією кісткового мозку, з високим ризиком пролонгованої тяжкої нейтропенії.
· Мобілізація стовбурових клітин периферичної крові (СКПК).
· Довготривала терапія для збільшення кількості нейтрофілів і зменшення частоти і тривалості інфекційних ускладнень у дітей та дорослих з тяжкою уродженою, періодичною або ідіопатичною нейтропенією (абсолютна кількість нейтрофілів ≤ 0,5×109/л) та тяжкими або рецидивуючими інфекціями в анамнезі.
· Зменшення ризику бактеріальних інфекцій при стійкій нейтропенії (абсолютна кількість нейтрофілів ≤ 1,0×109/л) у пацієнтів з розгорнутою стадією ВІЛ-інфекції у разі неефективності інших засобів контролю нейтропенії.
Гіперчутливість до діючої речовини або будь-якої з допоміжних речовин.
Лікування повинно проходити у співпраці з онкологічним центром, що має необхідне діагностичне обладнання, та фахівцями з достатнім досвідом роботи в сфері гематології та лікування із застосуванням гранулоцитарного колонієстимулюючого фактора людини. Процедури мобілізації та аферезу клітин повинні проводити спеціалісти з достатнім досвідом роботи в цій галузі і за наявності адекватного моніторингу клітин-попередників гемопоезу.
Звичайна цитотоксична хіміотерапія
Дозування
Рекомендована доза ТеваГрастиму складає 0,5 млн МО (5 мкг)/кг маси тіла один раз на добу. Першу дозу слід вводити не раніше ніж через 24 години після закінчення курсу цитотоксичної хіміотерапії. В рандомізованих клінічних дослідженнях підшкірно вводили дозу 23 млн МО (230 мкг)/м2/добу (4,0-8,4 мкг/кг маси тіла на добу).
Препарат ТеваГрастим вводять щоденно доти, доки кількість нейтрофілів після очікуваного зниження не відновиться до нормальних значень. У хворих, які одержують цитотоксичну хіміотерапію з приводу солідних пухлин, лімфом і лімфолейкозу, очікувана тривалість терапії, необхідна для виконання цих критеріїв, становить до 14 днів. Після індукційної та консолідаційної терапії гострого мієлолейкозу тривалість лікування може значно збільшитися (до 38 днів) залежно від типу, доз і схеми цитотоксичної хіміотерапії, яку застосовують.
Звичайно тимчасове збільшення кількості нейтрофілів спостерігається через 1-2 дні після початку лікування філграстимом пацієнтів, які отримують цитотоксичну хіміотерапію. Проте для досягнення стабільного терапевтичного ефекту терапію філграстимом не слід переривати до того, як кількість нейтрофілів після очікуваного максимального зниження не відновиться до нормальних значень. Не рекомендується відміняти лікування передчасно, раніше очікуваного максимального зниження кількості нейтрофілів.
Спосіб застосування
ТеваГрастим можна вводити шляхом щоденних підшкірних ін'єкцій або щоденних коротких (30-хвилинних) внутрішньовенних інфузій на 5% розчині глюкози. Більш бажаним є підшкірний шлях введення, оскільки є дані з клінічних випробувань разового застосування про те, що при внутрішньовенному введенні тривалість ефекту філграстиму може зменшуватися. Клінічна релевантність цих даних щодо багаторазового застосування не з'яcована. Шлях введення слід обирати залежно від особливостей кожного клінічного випадку.
Для підшкірного введення
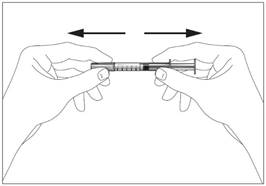 1a
1a 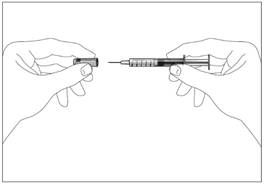 1b
1b
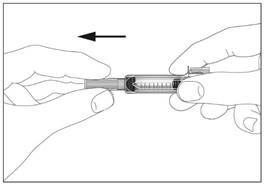 2a
2a 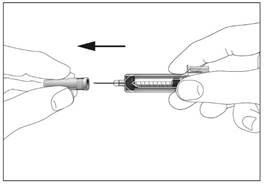 2b
2b
Шприц без пристрою для безпечного введення та запобігання поранень
голкою чи повторного використання (рис. 1а, 1b)
Шприц з пристроєм для безпечного введення та запобігання
поранень голкою чи повторного використання (рис. 2а, 2b)
 3
3 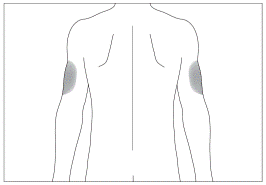 4
4
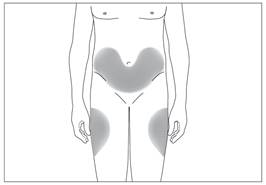
Переважні ділянки тіла для підшкірного введення (рис. 3, 4)
 5
5
 6
6 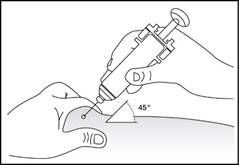 7
7
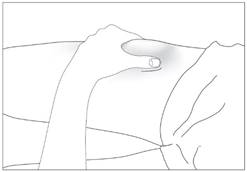
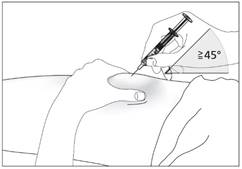
Підшкірне введення препарату (рис. 5-7)
1. Продезінфікуйте місце введення серветкою, змоченою в спиртовому розчині. Затисніть ділянку шкіри між великим та вказівним пальцями, не стискаючи її (рис. 5).
2. Введіть голку на всю довжину в шкіру (рис. 6 – введення шприца без захисного пристрою; рис. 7 – введення шприца з захисним пристроєм).
3. Злегка потягніть на себе поршень шприца, щоб перевірити, чи при введенні не проколено кровоносну судину. У разі, якщо ви помітили кров у шприці, витягніть голку та введіть її повторно в іншу ділянку шкіри.
Слід вводити препарат щоденно в один і той же час.
Для уникнення болю краще за все щоденно міняти місце введення.
Шприци без пристрою для безпечного введення
Вводити препарат необхідно повільно та рівномірно, затиснувши шкіру між пальцями.
Після введення препарату, спочатку витягують голку, а потім відпускають шкіру.
Для кожної наступної ін'єкції використовують окремий шприц. Забороняється повторне введення ТеваГрастиму, що залишився у шприці.
 8
8
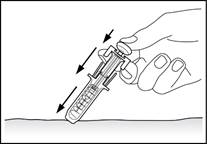
Шприци з пристроєм для безпечного введення
Вводити препарат необхідно повільно та рівномірно, затиснувши шкіру між пальцями, до повного введення дози та зупинки руху поршня шприца.
Забороняється прикладати надмірну силу при натисканні на поршень.
Після введення препарату витягують голку, продовжуючи натискати пальцем на поршень, а потім відпускають шкіру (рис. 8).
Після того як палець знімуть з поршня, захисний пристрій шприца швидко опуститься на голку, щоб закрити її.
Для кожної наступної ін'єкції використовують окремий шприц. Забороняється повторне введення ТеваГрастиму, що залишився у шприці.
Мієлоаблативна терапія з подальшою трансплантацією кісткового мозку
Дозування
Рекомендована початкова доза складає 1,0 млн МО (10 мкг)/кг маси тіла на добу.
Першу дозу ТеваГрастиму слід вводити не раніше ніж через 24 години після проведення цитотоксичної хіміотерапії і не раніше ніж через 24 години після трансплантації кісткового мозку.
Після максимального зниження кількості нейтрофілів добова доза коригується залежно від зміни кількості нейтрофілів (див. табл. 1).
Таблиця 1
|
Кількість нейтрофілів |
Доза філграстиму |
|
> 1,0×109/л протягом 3-х днів поспіль |
Зменшують до 0,5 млн МО (5 мкг)/кг/добу |
|
Потім, якщо абсолютна кількість нейтрофілів залишається > 1,0×109/л протягом наступних 3-х днів поспіль |
Філграстим відміняють |
|
Якщо під час лікування абсолютна кількість нейтрофілів знижується до рівня | |
Спосіб застосування
ТеваГрастим можна вводити шляхом 30‑хвилинної або 24-годинної внутрішньовенної інфузії або безперервної 24‑годинної підшкірної інфузії. ТеваГрастим слід розводити у 20 мл 5% розчину глюкози для інфузій.
Мобілізація стовбурових клітин периферичної крові у пацієнтів, які одержують мієлосупресивну або мієлоаблативну терапію з подальшою аутологічною трансплантацією СКПК
Дозування
Для мобілізації СКПК при застосуванні як монотерапії рекомендована доза філграстиму становить 1,0 млн МО (10 мкг)/кг на добу протягом 5-7 днів поспіль. Зазвичай досить одного або двох лейкаферезів на 5-й або 6-й день. У разі додаткового лейкаферезу призначення філграстиму в тій же дозі необхідно продовжувати до завершального лейкаферезу.
Для мобілізації СКПК після мієлосупресивної хіміотерапії рекомендована доза становить 0,5 млн МО (5 мкг)/кг на добу, починаючи з першого дня після завершення хіміотерапії і доти, доки кількість нейтрофілів після очікуваного максимального зниження не відновиться до нормальних значень. Лейкаферез слід проводити протягом періоду зростання абсолютної кількості нейтрофілів з менше 0,5×109/л до більше 5,0×109/л. Хворим, які не одержували інтенсивної хіміотерапії, іноді достатньо лише одного лейкаферезу. В інших випадках рекомендується проводити додаткові лейкаферези.
Спосіб застосування
При застосуванні філграстиму для мобілізації СКПК як монотерапії препарат можна вводити у вигляді безперервної 24-годинної підшкірної інфузії або шляхом підшкірної ін'єкції. Для інфузії лікарський засіб ТеваГрастим розводять у 20 мл 5% розчину глюкози для інфузій.
При застосуванні філграстиму для мобілізації СКПК після мієлосупресивної хіміотерапії препарат слід вводити шляхом підшкірної ін'єкції.
Мобілізація стовбурових клітин периферичної крові у здорових донорів для алогенної трансплантації СКПК
Дозування
Для мобілізації СКПК у здорових донорів філграстим слід вводити в дозі 1,0 млн МО (10 мкг)/кг на добу протягом 4-5 днів поспіль. Лейкаферез слід починати на 5-й день терапії і у разі потреби продовжити до 6-го дня з метою одержання 4×106CD34+-клітин/кг маси тіла реципієнта.
Спосіб застосування
Філграстим слід вводити шляхом підшкірної ін'єкції.
Тяжка хронічна нейтропенія
Дозування
Уроджена нейтропенія. Рекомендована початкова доза становить 1,2 млн МО (12 мкг)/кг на добу одноразово або за кілька введень.
Ідіопатична або періодична нейтропенія. Рекомендована початкова доза становить 0,5 млн МО (5 мкг)/кг на добу одноразово або за кілька введень.
Корекція дози. Філграстим слід вводити щоденно шляхом підшкірної ін'єкції до досягнення і стабільного перевищення кількості нейтрофілів 1,5×109/л. Після досягнення терапевтичного ефекту визначають мінімальну ефективну дозу для підтримання цього рівня. Для підтримання необхідної кількості нейтрофілів потрібне тривале щоденне введення препарату. Через 1 або 2 тижні лікування початкову дозу можна подвоїти або зменшити вдвічі, залежно від ефекту терапії. Далі кожні 1-2 тижні проводять індивідуальну корекцію дози для підтримання середньої кількості нейтрофілів в діапазоні від 1,5×109/л до 10×109/л. Хворим з тяжкими інфекціями можна використовувати схему з більш швидким збільшенням дози. В клінічних дослідженнях 97% пацієнтів, які відповіли на лікування, дали повну відповідь після введення дози ≤ 2,4 млн МО (24 мкг)/кг на добу. Безпека застосування філграстиму при тривалому лікуванні пацієнтів з тяжкою хронічною нейтропенією дозами, що перевищують 2,4 млн МО (24 мкг)/кг на добу, не встановлена.
Спосіб застосування
Уроджена, ідіопатична або періодична нейтропенія. Філграстим слід вводити шляхом підшкірної ін'єкції.
Пацієнти з ВІЛ-інфекцією
Дозування
Для усунення нейтропенії. Рекомендована початкова доза становить 0,1 млн МО (1 мкг)/кг на добу зі збільшенням дози максимально до 0,4 млн МО (4 мкг)/кг на добу до стійкої нормалізації кількості нейтрофілів (абсолютна кількість нейтрофілів більше 2,0×109/л). В клінічних дослідженнях більше 90% пацієнтів відповіли на це дозування, досягнувши відновлення кількості нейтрофілів в середньому за 2 доби.
Незначній кількості пацієнтів (менше 10%) була необхідна доза до 1 млн МО (10 мкг)/кг на добу для усунення нейтропенії.
Для підтримання нормальної кількості нейтрофілів. Після усунення нейтропенії визначають мінімальну ефективну дозу препарату для підтримання нормальної кількості нейтрофілів. Рекомендується починати з введення 30 млн МО (300 мкг) на добу через день. Надалі може бути потрібна індивідуальна корекція дози залежно від рівня нейтрофілів у пацієнта для підтримання кількості нейтрофілів більше 2,0×109/л. В клінічних дослідженнях доза 30 млн МО (300 мкг) на добу з 1 по 7 день тижня була достатньою для підтримання абсолютної кількості нейтрофілів більше 2,0×109/л з середньою частотою введення 3 рази на тиждень. Для підтримання абсолютної кількості нейтрофілів більше 2,0×109/л може бути потрібне тривале застосування препарату.
Спосіб застосування
Усунення нейтропенії або підтримання нормальної кількості нейтрофілів. Філграстим слід вводити шляхом підшкірної ін'єкції.
Особливі категорії пацієнтів
Застосування пацієнтам літнього віку
Клінічні дослідження філграстиму включали невелику кількість пацієнтів літнього віку, але спеціальних досліджень застосування цій групі хворих не проводилось, таким чином, специфічних рекомендацій щодо дозування зробити не можна.
Застосування пацієнтам з порушенням функції нирок або печінки
Пацієнти з тяжкими порушеннями функції нирок або печінки не потребують корекції дози, оскільки дослідження продемонстрували, що їхні фармакокінетичні та фармакодинамічні показники подібні до таких у здорових добровольців.
Застосування дітям з тяжкою хронічною нейтропенією та онкологічними захворюваннями
65% пацієнтів, що брали участь у програмі клінічних досліджень лікування тяжкої хронічної нейтропенії, були віком до 18 років. Ефективність лікування була очевидна для цієї вікової групи, яка включала більшість пацієнтів з уродженою нейтропенією. Не було різниці в профілях безпеки для дітей, що лікувались від тяжкої хронічної нейтропенії.
Клінічні дослідження продемонстрували однакову ефективність та безпеку філграстиму для дорослих та дітей, які отримували цитотоксичну хіміотерапію.
Рекомендації щодо дозування для дітей такі ж, як і для дорослих, що отримують мієлосупресивну цитотоксичну хіміотерапію.
Особливості поводження з препаратом
Препарат ТеваГрастим за потреби розводять 5% (50 мг/мл) розчином глюкози для інфузій.
Розведення до кінцевої концентрації менше ніж 0,2 млн МО (2 мкг)/мл не рекомендується ні за яких умов.
Розчин повинен бути візуально перевірений перед застосуванням. Тільки прозорий розчин без видимих часточок може бути використаний.
Якщо філграстим розводиться до концентрації менше 1,5 млн МО (15 мкг)/мл, необхідно додавати сироватковий альбумін людини в такій кількості, щоб кінцева концентрація становила 2 мг/мл. Наприклад, при розведенні загальної дози філграстиму менше 30 млн МО (300 мкг) до кінцевого об'єму розчину 20 мл слід додати 0,2 мл 20% (200 мг/мл) розчину альбуміну людини.
ТеваГрастим не містить консервантів. Тому через можливий ризик мікробної контамінації шприци з препаратом призначені тільки для одноразового застосування.
Розведений 5% розчином глюкози ТеваГрастим сумісний зі склом та низкою пластмас, у тому числі з полівінілхлоридом (ПВХ), поліолефіном (співполімер поліпропілену та поліетилену) і поліпропіленом.
Хімічна та фізична стабільність розведеного розчину для інфузій – 24 години при температурі від 2 до 8 °С. З мікробіологічної точки зору, препарат слід застосовувати негайно. Якщо препарат не був введений одразу після розведення, час та умови зберігання до використання є відповідальністю користувача та зазвичай становлять не більше 24 годин при температурі від 2 до 8 °С, якщо тільки розведення не було проведено в контрольованих та валідованих асептичних умовах.
Випадкове одноразове замороження шприців не впливає на стабільність ТеваГрастиму.
Діти.
Дані клінічних досліджень свідчать про те, що безпека та ефективність лікування філграстимом ідентичні у дорослих і дітей, які отримують цитотоксичну хіміотерапію.
Рекомендована доза для дітей та дорослих, що отримують мієлосупресивну цитотоксичну хіміотерапію, однакова.
Ниже собраны популярные вопросы пользователей сервиса Zdorovi.UA про Теваграстим раствор для ин. и инф. 48 млн МЕ шприц 0,8 мл №1, а также ответы на них.
· Скорочення тривалості нейтропенії і зменшення частоти фебрильної нейтропенії у хворих, які отримують цитотоксичну хіміотерапію з приводу злоякісних захворювань (за винятком хронічного мієлолейкозу і мієлодиспластичного синдрому).
· Скорочення тривалості нейтропенії у хворих, які отримують мієлоаблативну терапію з подальшою трансплантацією кісткового мозку, з високим ризиком пролонгованої тяжкої нейтропенії.
· Мобілізація стовбурових клітин периферичної крові (СКПК).
· Довготривала терапія для збільшення кількості нейтрофілів і зменшення частоти і тривалості інфекційних ускладнень у дітей та дорослих з тяжкою уродженою, періодичною або ідіопатичною нейтропенією (абсолютна кількість нейтрофілів ≤ 0,5×109/л) та тяжкими або рецидивуючими інфекціями в анамнезі.
· Зменшення ризику бактеріальних інфекцій при стійкій нейтропенії (абсолютна кількість нейтрофілів ≤ 1,0×109/л) у пацієнтів з розгорнутою стадією ВІЛ-інфекції у разі неефективності інших засобів контролю нейтропенії.
діюча речовина: філграстим;
1 попередньо наповнений шприц (0,5 мл розчину) містить філграстиму 30 млн МО (300 мкг);
1 попередньо наповнений шприц (0,8 мл розчину) містить філграстиму 48 млн МО (480 мкг);
допоміжні речовини: кислота оцтова льодяна, полісорбат 80, натрію гідроксид, сорбіт (Е 420), вода для ін'єкцій.
Лікування повинно проходити у співпраці з онкологічним центром, що має необхідне діагностичне обладнання, та фахівцями з достатнім досвідом роботи в сфері гематології та лікування із застосуванням гранулоцитарного колонієстимулюючого фактора людини. Процедури мобілізації та аферезу клітин повинні проводити спеціалісти з достатнім досвідом роботи в цій галузі і за наявності адекватного моніторингу клітин-попередників гемопоезу.
Звичайна цитотоксична хіміотерапія
Дозування
Рекомендована доза ТеваГрастиму складає 0,5 млн МО (5 мкг)/кг маси тіла один раз на добу. Першу дозу слід вводити не раніше ніж через 24 години після закінчення курсу цитотоксичної хіміотерапії. В рандомізованих клінічних дослідженнях підшкірно вводили дозу 23 млн МО (230 мкг)/м2/добу (4,0-8,4 мкг/кг маси тіла на добу).
Препарат ТеваГрастим вводять щоденно доти, доки кількість нейтрофілів після очікуваного зниження не відновиться до нормальних значень. У хворих, які одержують цитотоксичну хіміотерапію з приводу солідних пухлин, лімфом і лімфолейкозу, очікувана тривалість терапії, необхідна для виконання цих критеріїв, становить до 14 днів. Після індукційної та консолідаційної терапії гострого мієлолейкозу тривалість лікування може значно збільшитися (до 38 днів) залежно від типу, доз і схеми цитотоксичної хіміотерапії, яку застосовують.
Звичайно тимчасове збільшення кількості нейтрофілів спостерігається через 1-2 дні після початку лікування філграстимом пацієнтів, які отримують цитотоксичну хіміотерапію. Проте для досягнення стабільного терапевтичного ефекту терапію філграстимом не слід переривати до того, як кількість нейтрофілів після очікуваного максимального зниження не відновиться до нормальних значень. Не рекомендується відміняти лікування передчасно, раніше очікуваного максимального зниження кількості нейтрофілів.
Спосіб застосування
ТеваГрастим можна вводити шляхом щоденних підшкірних ін'єкцій або щоденних коротких (30-хвилинних) внутрішньовенних інфузій на 5% розчині глюкози. Більш бажаним є підшкірний шлях введення, оскільки є дані з клінічних випробувань разового застосування про те, що при внутрішньовенному введенні тривалість ефекту філграстиму може зменшуватися. Клінічна релевантність цих даних щодо багаторазового застосування не з'яcована. Шлях введення слід обирати залежно від особливостей кожного клінічного випадку.
Для підшкірного введення
 1a
1a  1b
1b
 2a
2a  2b
2b
Шприц без пристрою для безпечного введення та запобігання поранень
голкою чи повторного використання (рис. 1а, 1b)
Шприц з пристроєм для безпечного введення та запобігання
поранень голкою чи повторного використання (рис. 2а, 2b)
 3
3  4
4
Переважні ділянки тіла для підшкірного введення (рис. 3, 4)
 5
5
 6
6  7
7
Підшкірне введення препарату (рис. 5-7)
1. Продезінфікуйте місце введення серветкою, змоченою в спиртовому розчині. Затисніть ділянку шкіри між великим та вказівним пальцями, не стискаючи її (рис. 5).
2. Введіть голку на всю довжину в шкіру (рис. 6 – введення шприца без захисного пристрою; рис. 7 – введення шприца з захисним пристроєм).
3. Злегка потягніть на себе поршень шприца, щоб перевірити, чи при введенні не проколено кровоносну судину. У разі, якщо ви помітили кров у шприці, витягніть голку та введіть її повторно в іншу ділянку шкіри.
Слід вводити препарат щоденно в один і той же час.
Для уникнення болю краще за все щоденно міняти місце введення.
Шприци без пристрою для безпечного введення
Вводити препарат необхідно повільно та рівномірно, затиснувши шкіру між пальцями.
Після введення препарату, спочатку витягують голку, а потім відпускають шкіру.
Для кожної наступної ін'єкції використовують окремий шприц. Забороняється повторне введення ТеваГрастиму, що залишився у шприці.
 8
8
Шприци з пристроєм для безпечного введення
Вводити препарат необхідно повільно та рівномірно, затиснувши шкіру між пальцями, до повного введення дози та зупинки руху поршня шприца.
Забороняється прикладати надмірну силу при натисканні на поршень.
Після введення препарату витягують голку, продовжуючи натискати пальцем на поршень, а потім відпускають шкіру (рис. 8).
Після того як палець знімуть з поршня, захисний пристрій шприца швидко опуститься на голку, щоб закрити її.
Для кожної наступної ін'єкції використовують окремий шприц. Забороняється повторне введення ТеваГрастиму, що залишився у шприці.
Мієлоаблативна терапія з подальшою трансплантацією кісткового мозку
Дозування
Рекомендована початкова доза складає 1,0 млн МО (10 мкг)/кг маси тіла на добу.
Першу дозу ТеваГрастиму слід вводити не раніше ніж через 24 години після проведення цитотоксичної хіміотерапії і не раніше ніж через 24 години після трансплантації кісткового мозку.
Після максимального зниження кількості нейтрофілів добова доза коригується залежно від зміни кількості нейтрофілів (див. табл. 1).
Таблиця 1
|
Кількість нейтрофілів |
Доза філграстиму |
|
> 1,0×109/л протягом 3-х днів поспіль |
Зменшують до 0,5 млн МО (5 мкг)/кг/добу |
|
Потім, якщо абсолютна кількість нейтрофілів залишається > 1,0×109/л протягом наступних 3-х днів поспіль |
Філграстим відміняють |
|
Якщо під час лікування абсолютна кількість нейтрофілів знижується до рівня | |
Спосіб застосування
ТеваГрастим можна вводити шляхом 30‑хвилинної або 24-годинної внутрішньовенної інфузії або безперервної 24‑годинної підшкірної інфузії. ТеваГрастим слід розводити у 20 мл 5% розчину глюкози для інфузій.
Мобілізація стовбурових клітин периферичної крові у пацієнтів, які одержують мієлосупресивну або мієлоаблативну терапію з подальшою аутологічною трансплантацією СКПК
Дозування
Для мобілізації СКПК при застосуванні як монотерапії рекомендована доза філграстиму становить 1,0 млн МО (10 мкг)/кг на добу протягом 5-7 днів поспіль. Зазвичай досить одного або двох лейкаферезів на 5-й або 6-й день. У разі додаткового лейкаферезу призначення філграстиму в тій же дозі необхідно продовжувати до завершального лейкаферезу.
Для мобілізації СКПК після мієлосупресивної хіміотерапії рекомендована доза становить 0,5 млн МО (5 мкг)/кг на добу, починаючи з першого дня після завершення хіміотерапії і доти, доки кількість нейтрофілів після очікуваного максимального зниження не відновиться до нормальних значень. Лейкаферез слід проводити протягом періоду зростання абсолютної кількості нейтрофілів з менше 0,5×109/л до більше 5,0×109/л. Хворим, які не одержували інтенсивної хіміотерапії, іноді достатньо лише одного лейкаферезу. В інших випадках рекомендується проводити додаткові лейкаферези.
Спосіб застосування
При застосуванні філграстиму для мобілізації СКПК як монотерапії препарат можна вводити у вигляді безперервної 24-годинної підшкірної інфузії або шляхом підшкірної ін'єкції. Для інфузії лікарський засіб ТеваГрастим розводять у 20 мл 5% розчину глюкози для інфузій.
При застосуванні філграстиму для мобілізації СКПК після мієлосупресивної хіміотерапії препарат слід вводити шляхом підшкірної ін'єкції.
Мобілізація стовбурових клітин периферичної крові у здорових донорів для алогенної трансплантації СКПК
Дозування
Для мобілізації СКПК у здорових донорів філграстим слід вводити в дозі 1,0 млн МО (10 мкг)/кг на добу протягом 4-5 днів поспіль. Лейкаферез слід починати на 5-й день терапії і у разі потреби продовжити до 6-го дня з метою одержання 4×106CD34+-клітин/кг маси тіла реципієнта.
Спосіб застосування
Філграстим слід вводити шляхом підшкірної ін'єкції.
Тяжка хронічна нейтропенія
Дозування
Уроджена нейтропенія. Рекомендована початкова доза становить 1,2 млн МО (12 мкг)/кг на добу одноразово або за кілька введень.
Ідіопатична або періодична нейтропенія. Рекомендована початкова доза становить 0,5 млн МО (5 мкг)/кг на добу одноразово або за кілька введень.
Корекція дози. Філграстим слід вводити щоденно шляхом підшкірної ін'єкції до досягнення і стабільного перевищення кількості нейтрофілів 1,5×109/л. Після досягнення терапевтичного ефекту визначають мінімальну ефективну дозу для підтримання цього рівня. Для підтримання необхідної кількості нейтрофілів потрібне тривале щоденне введення препарату. Через 1 або 2 тижні лікування початкову дозу можна подвоїти або зменшити вдвічі, залежно від ефекту терапії. Далі кожні 1-2 тижні проводять індивідуальну корекцію дози для підтримання середньої кількості нейтрофілів в діапазоні від 1,5×109/л до 10×109/л. Хворим з тяжкими інфекціями можна використовувати схему з більш швидким збільшенням дози. В клінічних дослідженнях 97% пацієнтів, які відповіли на лікування, дали повну відповідь після введення дози ≤ 2,4 млн МО (24 мкг)/кг на добу. Безпека застосування філграстиму при тривалому лікуванні пацієнтів з тяжкою хронічною нейтропенією дозами, що перевищують 2,4 млн МО (24 мкг)/кг на добу, не встановлена.
Спосіб застосування
Уроджена, ідіопатична або періодична нейтропенія. Філграстим слід вводити шляхом підшкірної ін'єкції.
Пацієнти з ВІЛ-інфекцією
Дозування
Для усунення нейтропенії. Рекомендована початкова доза становить 0,1 млн МО (1 мкг)/кг на добу зі збільшенням дози максимально до 0,4 млн МО (4 мкг)/кг на добу до стійкої нормалізації кількості нейтрофілів (абсолютна кількість нейтрофілів більше 2,0×109/л). В клінічних дослідженнях більше 90% пацієнтів відповіли на це дозування, досягнувши відновлення кількості нейтрофілів в середньому за 2 доби.
Незначній кількості пацієнтів (менше 10%) була необхідна доза до 1 млн МО (10 мкг)/кг на добу для усунення нейтропенії.
Для підтримання нормальної кількості нейтрофілів. Після усунення нейтропенії визначають мінімальну ефективну дозу препарату для підтримання нормальної кількості нейтрофілів. Рекомендується починати з введення 30 млн МО (300 мкг) на добу через день. Надалі може бути потрібна індивідуальна корекція дози залежно від рівня нейтрофілів у пацієнта для підтримання кількості нейтрофілів більше 2,0×109/л. В клінічних дослідженнях доза 30 млн МО (300 мкг) на добу з 1 по 7 день тижня була достатньою для підтримання абсолютної кількості нейтрофілів більше 2,0×109/л з середньою частотою введення 3 рази на тиждень. Для підтримання абсолютної кількості нейтрофілів більше 2,0×109/л може бути потрібне тривале застосування препарату.
Спосіб застосування
Усунення нейтропенії або підтримання нормальної кількості нейтрофілів. Філграстим слід вводити шляхом підшкірної ін'єкції.
Особливі категорії пацієнтів
Застосування пацієнтам літнього віку
Клінічні дослідження філграстиму включали невелику кількість пацієнтів літнього віку, але спеціальних досліджень застосування цій групі хворих не проводилось, таким чином, специфічних рекомендацій щодо дозування зробити не можна.
Застосування пацієнтам з порушенням функції нирок або печінки
Пацієнти з тяжкими порушеннями функції нирок або печінки не потребують корекції дози, оскільки дослідження продемонстрували, що їхні фармакокінетичні та фармакодинамічні показники подібні до таких у здорових добровольців.
Застосування дітям з тяжкою хронічною нейтропенією та онкологічними захворюваннями
65% пацієнтів, що брали участь у програмі клінічних досліджень лікування тяжкої хронічної нейтропенії, були віком до 18 років. Ефективність лікування була очевидна для цієї вікової групи, яка включала більшість пацієнтів з уродженою нейтропенією. Не було різниці в профілях безпеки для дітей, що лікувались від тяжкої хронічної нейтропенії.
Клінічні дослідження продемонстрували однакову ефективність та безпеку філграстиму для дорослих та дітей, які отримували цитотоксичну хіміотерапію.
Рекомендації щодо дозування для дітей такі ж, як і для дорослих, що отримують мієлосупресивну цитотоксичну хіміотерапію.
Особливості поводження з препаратом
Препарат ТеваГрастим за потреби розводять 5% (50 мг/мл) розчином глюкози для інфузій.
Розведення до кінцевої концентрації менше ніж 0,2 млн МО (2 мкг)/мл не рекомендується ні за яких умов.
Розчин повинен бути візуально перевірений перед застосуванням. Тільки прозорий розчин без видимих часточок може бути використаний.
Якщо філграстим розводиться до концентрації менше 1,5 млн МО (15 мкг)/мл, необхідно додавати сироватковий альбумін людини в такій кількості, щоб кінцева концентрація становила 2 мг/мл. Наприклад, при розведенні загальної дози філграстиму менше 30 млн МО (300 мкг) до кінцевого об'єму розчину 20 мл слід додати 0,2 мл 20% (200 мг/мл) розчину альбуміну людини.
ТеваГрастим не містить консервантів. Тому через можливий ризик мікробної контамінації шприци з препаратом призначені тільки для одноразового застосування.
Розведений 5% розчином глюкози ТеваГрастим сумісний зі склом та низкою пластмас, у тому числі з полівінілхлоридом (ПВХ), поліолефіном (співполімер поліпропілену та поліетилену) і поліпропіленом.
Хімічна та фізична стабільність розведеного розчину для інфузій – 24 години при температурі від 2 до 8 °С. З мікробіологічної точки зору, препарат слід застосовувати негайно. Якщо препарат не був введений одразу після розведення, час та умови зберігання до використання є відповідальністю користувача та зазвичай становлять не більше 24 годин при температурі від 2 до 8 °С, якщо тільки розведення не було проведено в контрольованих та валідованих асептичних умовах.
Випадкове одноразове замороження шприців не впливає на стабільність ТеваГрастиму.
Діти.
Дані клінічних досліджень свідчать про те, що безпека та ефективність лікування філграстимом ідентичні у дорослих і дітей, які отримують цитотоксичну хіміотерапію.
Рекомендована доза для дітей та дорослих, що отримують мієлосупресивну цитотоксичну хіміотерапію, однакова.
Важно! Обязательно получите консультацию лечащего врача перед тем, как купить Теваграстим раствор для ин. и инф. 48 млн МЕ шприц 0,8 мл №1.
Найдите товар в каталоге
Введите в поиск Теваграстим раствор для ин. и инф. 48 млн МЕ шприц 0,8 мл №1 и кликните на препарат. Если вы уже в карточке товара и вам доступны характеристики - пропустите этот шаг.
Проверьте наличие и стоимость
Нажмите кнопку "Выбрать аптеку", установите город и проверьте наличие Теваграстим раствор для ин. и инф. 48 млн МЕ шприц 0,8 мл №1 в удобной для вас аптеке.
Бронируйте несколько препаратов
Если кроме Теваграстим раствор для ин. и инф. 48 млн МЕ шприц 0,8 мл №1 вам необходимо оформить бронь на другие препараты, используйте иконку "В список".
Выберите аптеку
Чтобы купить Теваграстим раствор для ин. и инф. 48 млн МЕ шприц 0,8 мл №1, выберите аптеку на карте или в списке аптек, кликните на нее, и товар добавится в корзину.
Проверьте корзину
Проверьте, есть ли Теваграстим раствор для ин. и инф. 48 млн МЕ шприц 0,8 мл №1 и другие препараты в корзине, нажмите кнопку "Заказать" и укажите номер телефона.
Дождитесь подтверждения заказа
Дождитесь СМС сообщения с подтверждением бронирования препарата Теваграстим раствор для ин. и инф. 48 млн МЕ шприц 0,8 мл №1 и заберите его в аптеке.
Купить Теваграстим раствор для ин. и инф. 48 млн МЕ шприц 0,8 мл №1 в аптеках Украины можно сделав бронь через сервис zdorovi.ua. Забронировать Теваграстим раствор для ин. и инф. 48 млн МЕ шприц 0,8 мл №1 можно в таких городах: и в других населенных пунктах Украины.
Copyright © 2021-2024 Zdorovi.UA